再生医療開拓講座の研究内容について
滋賀医科大学では、2013年11月、生化学・分子生物学講座、再生・修復医学部門がスタートし、研究と教育に活躍していました。その後、2022年4月より、再生医療開拓講座と生命情報開拓講座で、それらが引き継がれる形で継続されています。
我々は、独自のテーマを持ち、難病治療への準備を進めています。1)骨髄を出発点とした生体再生システムとその異常の解明、2)7桁ペプチド配列を用いた、生体内での細胞標的化薬物輸送システム(バイオジップコード)の開発、という二大テーマのもと、具体的な難病克服に向けた研究を行っています。
生体内再生システム
当講座では、開設時より、様々な講座の研究者が集まり、難治性疾患の原因解明と新規治療法の開発を目的に研究してきました。「慢性疾患はどうして慢性なのか?どうして治癒しないのか?」という、慢性であることそのものに着目し、ブレイクスルーを探してきたのです。
糖尿病、神経難病、骨粗鬆症、脊髄損傷、神経因性疼痛、難治性皮膚潰瘍、多臓器不全などについて研究してきました。これらの疾患では、病気の進行を如何に抑えるのかが精一杯で、治癒させるめどは立っていません。そこで、様々な分野の専門家が集まり、臓器別カテゴリーを捨て去り、「治らないのはどうしてか」に焦点を絞り議論してきました。
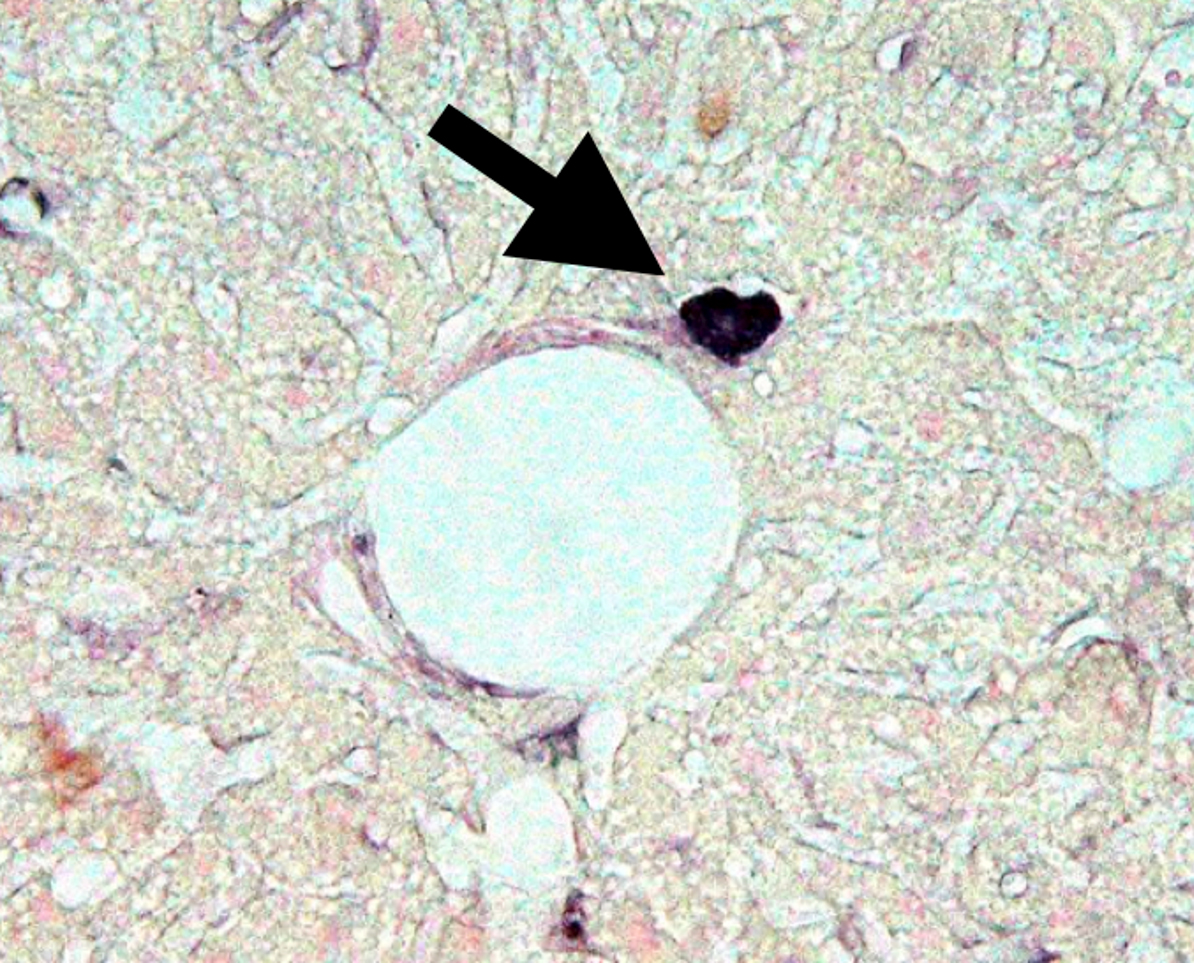
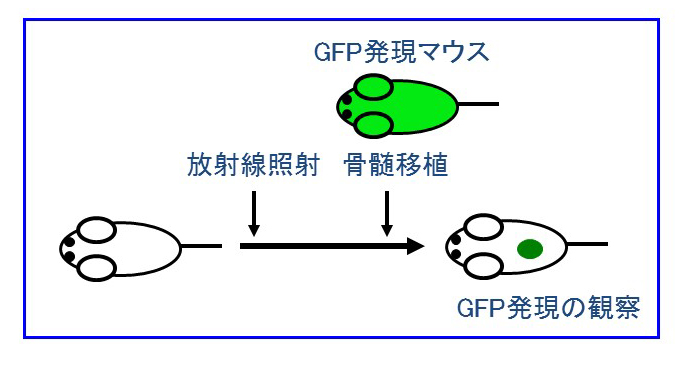
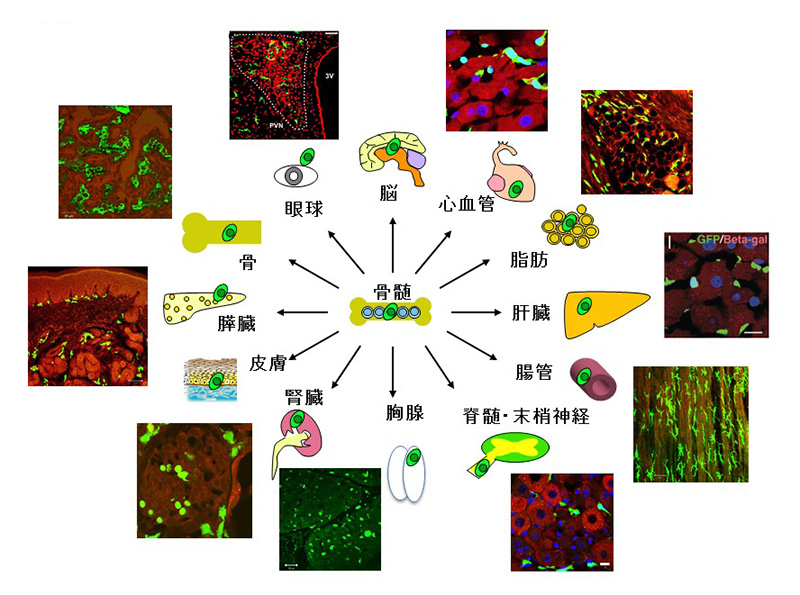
その結果、マーカータンパク質を発現する遺伝子改変マウスの骨髄を、疾患モデルマウスへと骨髄移植し、各臓器に起こった変化を詳細に観察するという手法により、「知られざる骨髄の役割」が見えてきたのです。
第4のホメオスタシス
我々の身体は様々な外的作用に対して、生体の恒常性を維持する機構、すなわちホメオスタシスを備えています。これまで、ホメオスタシスの維持には神経、免疫、内分泌という3要素が必要とされてきました。
これに対して、私たちは、新たに骨髄を出発点として、様々な臓器内へとホーミングし、その動作を監視し、壊れた場合は修復し、生体としての調和を作り出している細胞システムを発見し、生体の第4のホメオスタシス維持システムではないかと考えています。骨髄は血液細胞を作るという重要な役割を持っています。食菌作用や老廃物の処理に活躍するマクロファージも血管から臓器内へと進入する細胞です。
しかし、今回我々が見いだしたシステムはマクロファージのように一細胞成分ではなく、ダイナミックで巨大な細胞集団です。たいへん興味あることに、糖尿病を代表とする慢性疾患ではこのシステムがことごとく傷害されていました。
標的化薬物輸送(バイオジップコード)
もう一つのテーマは、薬物を目的細胞だけに標的輸送するシステムの開発です。経口薬でも、注射薬でも、現在使われている薬物は身体の中の治療したい細胞だけで働くというものはありません。どうしても、働いて欲しくない細胞にも運ばれその細胞に何らかの影響を与えます。
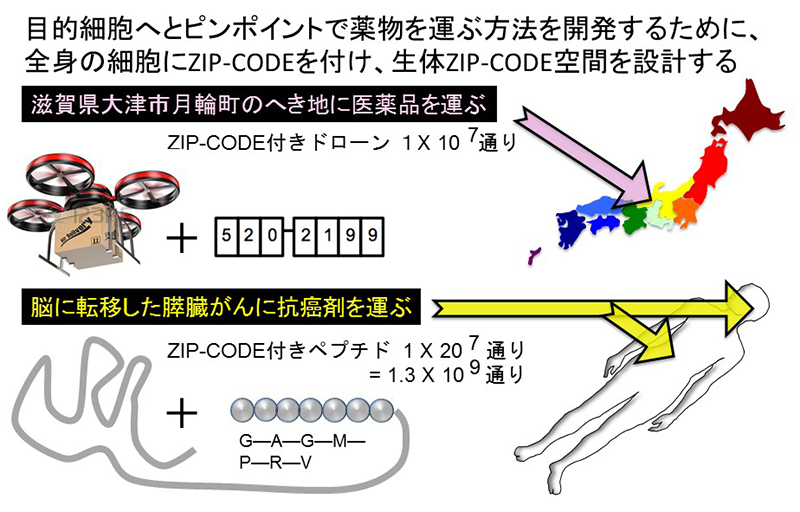
従って、標的細胞だけに薬物が運ばれ、他の細胞には運ばれないような輸送方法があれば良いのです。例えば、地球上では住所録やGPSを使用することにより、目的の位置情報を特定し、荷物を運ぶことができます。
我々の身体を構成している細胞について、同じこと行い、薬物輸送に使おうとすると、標的とする細胞に特異的な住所コードを付け、細胞がそれを認識すると、薬物輸送担体をそのまま取り込んでしまうようなシステムを作ればいいのです。そこで、生体の細胞を種類に応じて分類し、郵便番号の7桁の数字の代わりに特異的な7桁のアミノ酸配列を割り当てることができればと考えました。
アミノ酸は20種類あるので20の7乗通り、実に13億通りのコードが作れます。その中から、目的細胞だけが認識できるコードを選び、それを付けてさえおけば、血管や髄液を通して運ばれた薬物が目的細胞だけに到達できるというわけです。
生体内のナノドローン
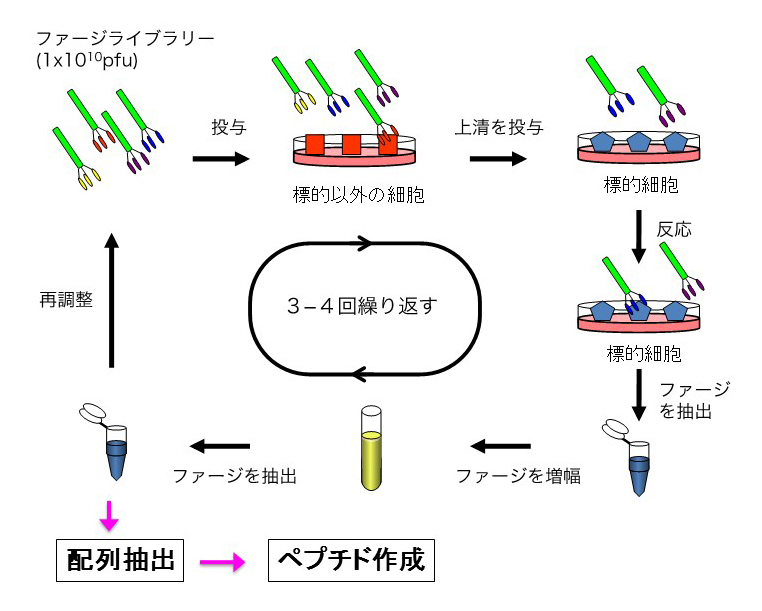
本研究ではファジライブラリー・キットを使用します。ライブラリーは7桁アミノ酸の全ての組合せを含んでいます。これをまず、目的以外の様々な細胞でサブトラクションしたのち、上清を採取し目的細胞に投与し、目的細胞に接着するファージを取り出し、それを再度増幅させます。サブトラクションの細胞を変化させ、この操作を何度か繰り返すことで目的細胞に特異的な配列がえられます。
ヒトの生体で実験をすることができないのでマウスやサルで行い、得られたコードが動物種によって変化せず共通するものであれば理想的です。実際に、痛みの中枢である脊髄後根神経節(dorsal root ganglion, DRG)神経細胞を標的として、得られた7桁アミノ酸コードについて種を越えて有効か否かを検討したところ、マウスで得られたコードはサルのDRG神経細胞ともしっかり反応することがわかりました。
ヒトでは細胞バンクや培養細胞が販売されており、これを利用することができます。標的細胞だけに薬物を届けるシステムは、いわば生体内のナノドローンのようなイメージです。この方法では、体内の細胞全てに親和性のない配列も得られます。これは正常細胞と反応しない配列であることから、もともと生体に存在しないがん幹細胞を狙う配列の候補でもあります。10億通りという数は、全てを賄ってなお余りある数ではないかと考えています。
病の幹細胞に直接アプローチ
機能不全に陥った病的幹細胞はニッチの中に隠れてしまい、薬物とのアクセスが拒否されています。しかし、今日では、ニッチを活性化することで、病的幹細胞をアクセス可能な空間へと追い出す方法が開発されています。
従って、搭載し使用するクスリは、新しいものでも、以前開発したけれど副作用で使えなかったものでも、どちらも使えます。標的コード付きナノドローンが確実に目的細胞だけに運んでくれるはずです。